La 36esima conferenza Nord Americana sulla Fibrosi Cistica si è tenuta dal 2 al 5 Novembre 2022 a Filadelfia, dove il 4 luglio 1776 venne firmata la Dichiarazione d’indipendenza degli Stati Uniti d’America e undici anni dopo, nel 1787, la Costituzione. A questi memorabili primati storici la città ne associa numerosi altri accademici, prima Università, prima Scuola di Medicina, primo ospedale, tutti fondati più o meno contemporaneamente, circa 250 anni fa.
Il meeting, organizzato dalla Cystic Fibrosis Foundation (CFF), si è svolto in presenza, presso il Pennsylvania Convention Center, dopo due anni di incontri virtuali dovuti al distanziamento sociale imposto dalla pandemia da Sars-CoV2. La partecipazione è stata come di consueto molto ampia, con quasi 6.000 iscritti (di cui 4453 in presenza), tra ricercatori, operatori sanitari appartenenti a tutte le figure del team multidisciplinare, rappresentanti istituzionali, di industrie farmaceutiche, e con la presentazione orale o in forma di poster di numerosi lavori scientifici.
La prima percezione avuta partecipando ai lavori è stata quella del grande entusiasmo e del forte spirito di squadra nel perseguire l’obiettivo di arrivare a trattare il difetto di base della malattia in tutti i pazienti, indipendentemente dal tipo di mutazioni di cui ogni individuo affetto è portatore. La terapia con modulatori della proteina CFTR (che permette di recuperare almeno in parte la sua funzione) è attualmente prescrivibile in un’elevata percentuale di pazienti (circa il 94% negli Stati Uniti), ma in percentuale minore in Italia ed altri paesi europei (intorno all’80%).
I risultati ottenuti con i farmaci modulatori ad alta efficacia finora disponibili sono stati straordinari, con segni evidenti che questa malattia grave e progressiva si stia trasformando in una condizione cronica, più facilmente gestibile e compatibile con una vita più lunga e soddisfacente.
Ci sono state, in plenaria, alcune testimonianze di persone con FC, piene di entusiasmo e riconoscenza verso la comunità scientifica che si è dedicata per anni alla Fibrosi Cistica con costanza e perseveranza, riportando in dettaglio come la loro vita sia davvero cambiata.
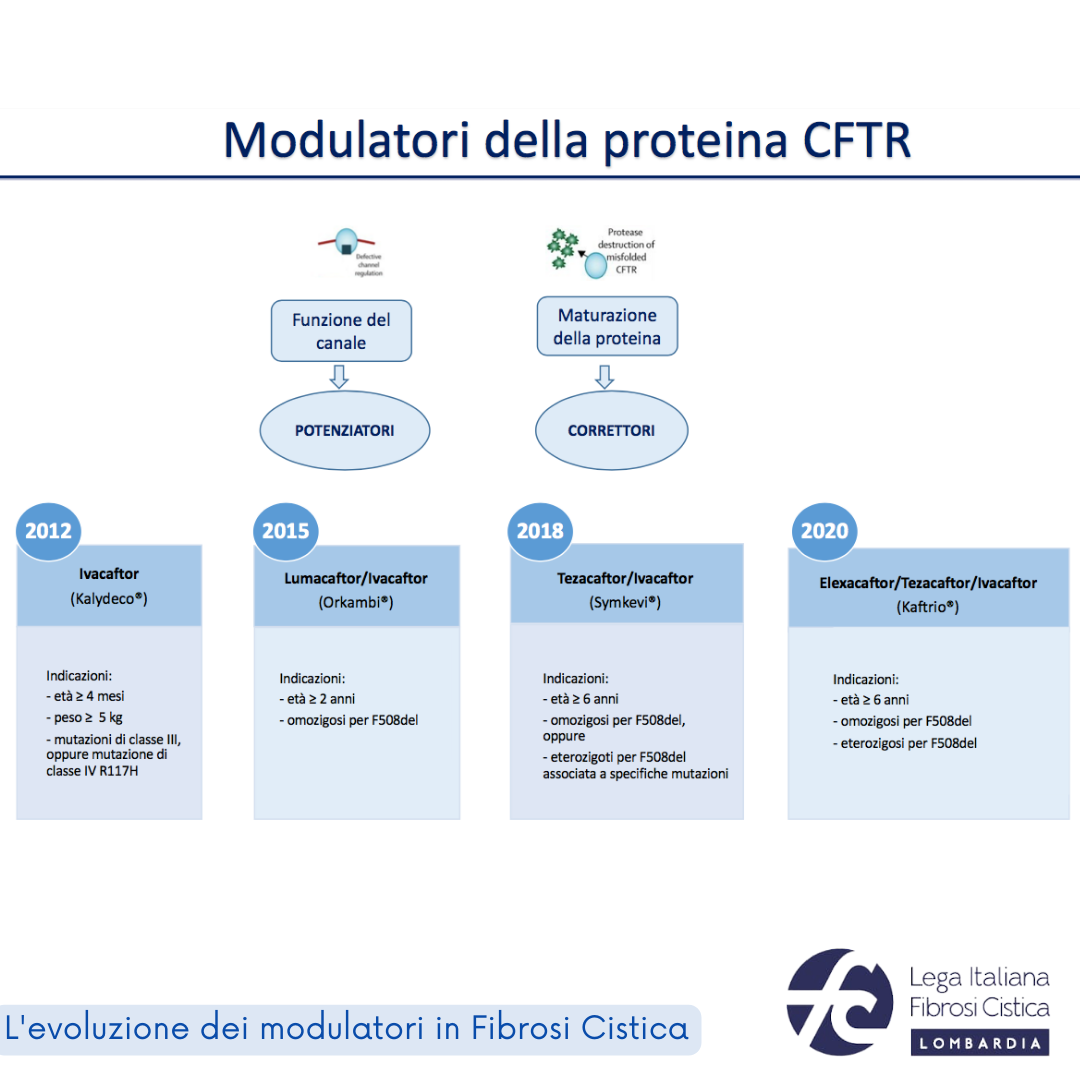
In vari simposi, oltre che nelle sessioni plenarie, sono stati illustrati i benefici ottenuti nei pazienti trattati con i farmaci modulatori sviluppati negli ultimi 10 anni, la cui efficacia è andata aumentando nel tempo (fare riferimento alla slide sui modulatori): miglioramento della funzione respiratoria e dei sintomi della malattia polmonare, con una significativa riduzione delle riacutizzazioni respiratorie e dei ricoveri, aumento del benessere generale, miglioramento dello stato nutrizionale e della crescita, e minor progressione del danno polmonare. Oltretutto i dati dei Registri nazionali della FC stanno fornendo evidenza di un miglioramento della sopravvivenza.
La CFF ha anche finanziato diversi studi multicentrici che hanno coinvolto più di 7500 partecipanti, allo scopo di esplorare varie problematiche, quali la possibilità di semplificare lo schema terapeutico finora raccomandato (studio Simplify, 700 persone arruolate), di definire come sta evolvendo la possibilità di gravidanza nelle donne affette da FC (Mayflower, 300 persone arruolate), degli aspetti microbiologici (Promise, 480 persone arruolate), e anche di stabilire se sia possibile utilizzare le concentrazioni di cloro nel sudore per ottimizzare la terapia con modulatori, analogamente a quanto si sta facendo da anni con i valori di pressione arteriosa per l’ipertensione (Check SS, 5000 persone arruolate).
Tuttavia, nonostante questo successo, il lavoro sin qui fatto viene considerato incompleto, perché ancora molti pazienti non possono accedere a questi farmaci in quanto portatori di mutazioni rare, non responsive o portatori di mutazioni di stop (dette anche nonsenso) che rendono impossibile la sintesi della proteina CFTR e quindi la possibilità di recuperarne la funzione con i farmaci modulatori.
È riemerso con forza l’obiettivo ambizioso di sviluppare la terapia genica, in grado di trasformare la malattia indipendentemente dal tipo di mutazioni presenti nelle persone affette: la parola d’ordine al meeting è stata “Until it’s done” (perseguire l’obiettivo fino a quando non sarà portato a termine).
Speranza per tutti: affrontare i bisogni di chi è portatore di mutazioni che non rispondono ai modulatori è una priorità
Già nella prima Sessione Plenaria (intitolata “Hope for All: addressing the needs of those with untreated CF mutations” sono state messe a fuoco le strategie adottate per affrontare questo percorso verso una cura definitiva per tutti i pazienti (Path to a cure, many routes one mission).
Un ambizioso progetto a lungo termine, con un investimento di 500 milioni di dollari fino al 2025, per coinvolgere il meglio in termini di scienziati, tecnologie e strumenti e che dispone di una pipeline terapeutica con il più alto numero di programmi attivati rispetto al passato. Sono già state avviate collaborazioni con industrie leader nel settore della genetica, e sono partiti 35 importanti programmi di ricerca per sviluppare terapie innovative quali la terapia con RNA, la terapia genica e di gene editing. Alcuni di questi studi sono già in corso, altri partiranno nei prossimi 18 mesi.
Le nuove strategie terapeutiche sono state spiegate in dettaglio.
Strategie per la correzione delle mutazioni di stop (dette anche mutazioni nonsenso)
Per le mutazioni di stop, per esempio, vi sono reali ragioni di ottimismo circa la possibilità di poterle correggere. Si tratta di mutazioni in cui la presenza di un anomalo segnale di stop nella sequenza del gene (DNA) porta all’interruzione della traduzione del messaggio e alla sintesi di una proteina troncata e non funzionante. Correggere queste mutazioni è stato un obiettivo terapeutico difficilissimo, che è stato perseguito per almeno 20 anni, con risultati deludenti. Si sono all’inizio utilizzate singole molecole (aminoglicosidi, PTC24, Elox2) capaci di inattivare il segnale di stop, cercando di impedire la interruzione della traduzione (readthrough), ma nessuno di questi composti ha portato ai risultati attesi.
Nel frattempo, le conoscenze dei meccanismi molecolari che governano la sintesi delle proteine nella cellula sono molto aumentate e si è capito che, per recuperare la funzione della proteina CFTR mutata per mutazioni di stop era necessario cambiare approccio, agendo su diversi meccanismi patologici in causa. Esattamente come è stato fatto per TRIKAFTA, quando, utilizzando una combinazione di tre farmaci (due correttori e un potenziatore), si è riusciti a recuperare un livello più elevato di funzione di proteina CFTR rispetto al recupero ottenuto con due soli farmaci, con risultati clinici molto migliori.
Lo stesso percorso è stato intrapreso per le mutazioni di stop, e le prove condotte in laboratorio indicano che questa dovrebbe essere la strada giusta. In particolare, alla terapia “readthrough”, basata cioè su molecole che legandosi al codone di stop consentono che la traduzione del messaggio prosegua e la proteina possa essere sintetizzata in tutta la sua lunghezza, potranno essere affiancati da altri farmaci (foto). Per esempio, per poter disporre di una buona quantità di proteina CFTR, è importante aumentare i livelli di RNA messaggero, che, se sono presenti mutazioni di stop, viene rapidamente degradato dai sistemi di sorveglianza della cellula. Tra i farmaci da associare quindi, RNA messaggero o inibitori dei fattori che lo distruggono e, infine, i modulatori CFTR, per aumentare la funzione della proteina ripristinata dalla terapia “readthrough”, che potrebbe essere subottimale ai fini del trasporto ionico.
Resta ancora molto da fare, test preclinici, valutazioni in modelli animali e, infine trials clinici, ma l’ottimismo per questa terapia combinata con più farmaci nasce proprio dal fatto che i livelli di funzione della proteina raggiunti in laboratorio di efficacia clinica.
RNA messaggero
Per quanto riguarda l’RNA messaggero, è di pochi giorni fa l’annuncio da parte di Vertex Pharmaceuticals che la FDA – Food and Drug Administration, l’ente governativo statunitense che si occupa della regolamentazione dei farmaci, ha approvato la partenza della sperimentazione clinica di una nuova terapia a base di mRNA per via inalatoria (VX-522). Per maggiori specifiche fare riferimento a un articolo già pubblicato e interamente dedicato a questo nuovo traguardo di ricerca.
Oligonucleotidi antisenso (ASO), già utilizzati in alcune malattie genetiche gravi
Un altro approccio promettente per correggere mutazioni non responsive ai modulatori disponibili è rappresentato dagli oligonucleotidi antisenso (ASO). Si tratta di piccoli frammenti di nucleotidi (simili a quelli presenti nel DNA e RNA) creati per legarsi appositamente a specifiche sequenze di RNA e questo permette di controllare e alterare l’espressione genica.
Questa tecnologia molto avanzata è stata già utilizzata con successo in alcune malattie genetiche gravi, prima tra tutte l’atrofia muscolare spinale (SMA), una malattia rara neuromuscolare caratterizzata dalla perdita dei neuroni che trasportano i segnali dal sistema nervoso centrale ai muscoli, controllandone il movimento. Nella sua forma più grave, esordisce prima dei 6 mesi d’età, compromette l’acquisizione delle capacità motorie, la respirazione e la deglutizione, e i bambini che ne sono affetti non sono in grado di vivere oltre i 2 anni senza supporto respiratorio. In questi casi si è utilizzato un oligonucleotide antisenso sintetico che si lega a uno specifico tratto di RNA per indurre un gene complementare a quello difettoso a produrre il “fattore di sopravvivenza dei motoneuroni” funzionante, a lunghezza completa, alleviando così i sintomi della malattia.
La tecnologia per produrre oligonucleotidi antisenso sintetici è quindi già ben collaudata (sono anche utilizzati per il trattamento della distrofia muscolare di Duchenne) e si pensa di poterli utilizzare per correggere mutazioni di splicing, frameshift e nonsenso nella Fibrosi Cistica. Per queste ultime, gli oligonucleotidi antisenso potrebbero essere utilizzati per bloccare il tratto di RNA trascritto in cui è situata il segnale di stop, in modo da mascherarlo, consentendo la produzione di proteine parzialmente attive. Sono stati prodotti oligonucleotidi antisenso per bloccare il tratto di trascritto in cui è situata la mutazione di stop W1282X e ciò ha portato alla produzione di proteina CFTR parzialmente attiva, indicando il potenziale beneficio di questo approccio terapeutico in persone che hanno questa mutazione e la necessità di condurre trial clinici.
Nuovi farmaci modulatori
Infine, va considerato che per altri tipi di mutazioni non corregibili, sono già in fase avanzata di sviluppo nuovi farmaci modulatori con meccanismi di azione diversi da quelli dei modulatori già disponibili. La loro efficacia dovrà essere testata, in associazione alle cosidette prove di teratyping in vitro, che consistono nel mettere a contatto cellule epiteliali prelevate dalla mucosa nasale o rettale del paziente con i farmaci da testare, per documentare la risposta.
Progressi anche per le terapie standard
Al meeting di Filadelfia si è parlato estesamente anche delle attività in corso per risolvere i problemi clinici tuttora posti dalla malattia (infezioni, problemi gastroenterici, trapianto di polmone) e per migliorare i benefici clinici e affrontare meglio il problema delle disparità nelle cure, argomenti di cui parlerò nel prossimi articoli.
Articolo a cura di Carla Colombo, Consulente scientifico di LIFC Lombardia.